El uso correcto de hormonas vegetales promueve el incremento en cantidad y calidad de las cosechas de la mayoría de los cultivos. Muchos de estos compuestos de tipo hormonal se aislaron o se identificaron por primera vez de las mismas plantas; sin embargo, por su poca o nula posibilidad para producirse a escalas industriales o por su alta inestabilidad, se han buscado opciones que sustituyan de manera eficiente la función de dichos compuestos; es así como nacen las hormonas de síntesis para promover el desarrollo y crecimiento de plantas cultivadas, compuestos que se popularizaron mucho por varios factores, entre ellos sus costos razonables y su disponibilidad en el mercado.

Sin embargo, la necesidad de productos agrícolas (frutas y verduras) en mayor grado posible: “naturales”, orgánicos o “cero residuos”, ha traído nuevamente la necesidad de voltear la mirada a esos compuestos naturales que la planta produce de manera normal y que tiene potencial para su producción en altos volúmenes.
Dentro de las hormonas, de las que se requiere, por las necesidades en el mercado, sustitución por fuentes naturales encontramos a las auxinas, el ácido abscísico, brasinoesteroides, citoquininas, giberelinas, etileno, ácido jasmónico y ácido salicílico. En esta nota técnica hablaremos de las auxinas y las fuentes naturales de producción con las que hoy en día contamos.
Auxinas.
Las Auxinas son hormonas de crecimiento de plantas, debido a su capacidad de estimular el crecimiento diferencial en respuesta a estímulos de luz (Zhao, 2010). Son las fitohormonas que juegan el rol más importante en el desarrollo de las plantas (Wiśniewska, et al., 2006). Se han descrito cuatro auxinas naturales sintetizadas por plantas: AIA, ácido indol-3-butírico (IBA), ácido 4-cloroindol-3-acético (4-Cl- AIA) y ácido fenilacético (PAA) (Simon y Petrášek, 2007).

La industria agroquímica ha desarrollado auxinas sintéticas que imitan la estructura de AIA. Las auxinas sintéticas más ampliamente utilizadas como herbicidas son el ácido 2,4-diclorofenoxiacético (2,4-D) y el ácido naftaleno-1-acético (NAA) (Simon y Petrášek, 2007). En contraste con AIA, estos herbicidas poseen una larga vida meda, debido a su alta estabilidad en plantas superiores y, por lo tanto, mayor efectividad que AIA. En bajas concentraciones son capaces de estimular los procesos de desarrollo y crecimiento de plantas, pero a altas concentraciones el crecimiento se ve perturbado y se daña la planta causando su muerte (Grossmann, 2007).
Auxinas naturales: Ácido indol-3-acético (AIA)
El AIA es la principal auxina nativa de las plantas superiores (Bonner y Bandurski, 1952). El AIA está involucrado en el crecimiento y desarrollo de las plantas, principalmente en una serie de procesos fisiológicos que incluyen el alargamiento y división celular, diferenciación de tejido, fototropismo, gravitropismo y en respuestas defensivas, destacando un importante rol en la formación del xilema y la raíz (Davies, P. J, 1995). La biosíntesis de AIA no está limitada a las plantas superiores. Organismos como bacterias, hongos y algas son capaces de sintetizar AIA, lo que puede afectar el crecimiento y el desarrollo de las plantas (Lee, et al., 2004). En bacterias, la producción de AIA es una capacidad relevante, tanto de PGPBs (plant-growth promoting bacteria), como de bacterias fitopatógenas (Patten y Glick, 2002). Las plantas superiores exudan, entre otros componentes el aminoácido triptófano, que es el principal precursor para la biosíntesis de AIA microbiano (Kravchenko, et al., 2004).

Biosíntesis de AIA en bacterias.
Debido, posiblemente, a la producción de exudados ricos en triptófano en la rizósfera, gran cantidad de bacterias habitantes naturales de esa zona, producen de manera natural AIA. Spaepen, et al, 2007, observaron gran similitud en las vías de síntesis de AIA y bacterias.
La producción de AIA de estas bacterias habitantes de la rizósfera, puede beneficiar o afectar el desarrollo óptimo de las plantas. Las bacterias productoras de AIA (BIP, del inglés bacterial IAA producer) tienen el potencial de interferir con los procesos de incorporación de AIA en las plantas. La consecuencia para la planta depende de la cantidad de AIA producido y la sensibilidad del tejido de la planta a los cambios en la concentración de AIA (Leveau y Lindow, 2005), lo que se asocia a la vía biosintética utilizada por las bacterias asociadas a plantas (Spaepen, et al, 2007).

Algunas bacterias fitopatógenas como Agrobacterium spp. y Pseudomonas savastanoi pv. savastanoi causan en el tejido vegetal tumores y corona de agallas, respectivamente, que en plantas jóvenes significan retrasos en el crecimiento, el desarrollo anormal, la susceptibilidad a otras enfermedades o la muerte de la planta (Jameson, 2000). Por otra parte, la PGPB Azospirillum favorece el desarrollo de la raíz (Spaepen, et al, 2007).
El triptófano es el principal precursor en las vías de biosíntesis de AIA en bacterias (Spaepen, et al, 2007). Diferentes vías de síntesis de AIA han sido identificadas en bacterias. Cinco dependientes de triptófano. Las vías de síntesis de AIA más importantes y ampliamente distribuidas son la vía indol-3- piruvato (IPA) y la vía indol-3- acetamida (IAM) (Figura 1). La vía IPA ha sido reportada principalmente en PGPB, mientras que la vía IAM ha sido descrita en bacterias fitopatógenas (Spaepen, et al, 2007).
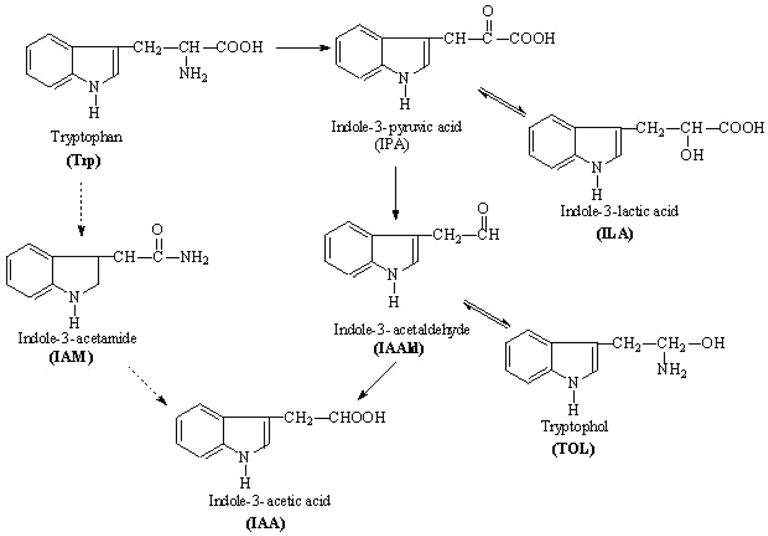
Producción de AIA vía indol-3-piruvato (IPA)
Varios investigadores han descrito de ruta de síntesis de AIA vía IPA, esta ruta parte de la presencia de Triptofano, el cual se transforma a ácido indol-3-pirúvico (IPA) por una aminotransferasa, en una segunda etapa, ese ácido indol-3-pirúvico se descarboxila a ácido indol-3-acetaldehído (AIAld) por la indol-3-piruvato descarboxilasa (IPDC), siendo esta la etapa limitante de la síntesis. El gen ipdC que codifica para la enzima IPDC ha sido caracterizado en algunas bacterias como Azospirillum brasilense, E. cloacae, Pseudomonas putida, P. agglomerans y Paenibacillus polymyxa. En la etapa final, el AIAld es oxidado a AIA por la indol-3-acetaldehído deshidrogenasa (Spaepen, et al, 2007). Es decir, se ha comprobado que estas bacterias codifican la enzima IPDC y por lo tanto; la descarboxilación del ácido indol-3-acetaldehído puede darse y así sintetizarse así el AIA a través de Triptofano.
Finalmente, podemos decir que el AIA producido por PGPB presenta un gran impacto sobre su actividad promotora del crecimiento de plantas (Vega-Celedón, et al., 2016) y representa un gran potencial no solo para producir AIA en laboratorio, si no, para la inoculación de semillas y plántulas con estas cepas bacterianas y que continúen la producción de AIA in situ.
Bibliografía.
Bonner, J. y Bandurski, R. S. 1952.‘‘Studies of the Physiology, Pharmacology, and Biochemistry of the Auxins’’. Annual Review of Plant Physiology, vol. 3, no. 1, 1 de junio de 1952, pp. 59-86, ISSN 0066-4294, DOI 10.1146/annurev. pp.03.060152.000423.
Davies, P. J. 1995. Plant hormones: physiology, biochemistry and molecular biology [en línea]. edit. Springer Netherlands, Dordrecht, 1995, ISBN 978-0-7923-2985-5, [Consultado: 14 de enero de 2019], Disponible en: <http://link.springer.com/10.1007/978-94-011-0473-9>.
Grossmann, K. ‘‘Auxin herbicide action: lifting the veil step by step’’. Plant Signaling & Behavior, vol. 2, no. 5, 2007, pp. 421–423, ISSN 1559-2316, 1559-2324, DOI 10.4161/psb.2.5.4417.
Jameson, P. E., 2000. ‘‘Cytokinins and auxins in plant-pathogen interactions – An overview’’. Plant Growth Regulation, vol. 32, no. 2-3, noviembre de 2000, pp. 369- 380, ISSN 0167-6903, 1573-5087, DOI 10.1023/A:1010733617543.
Kravchenko, L. V.; Azarova, T. S.; Makarova, N. M. y Tikhonovich, I. A. 2004. ‘‘The Effect of Tryptophan Present in Plant Root Exudates on the Phytostimulating Activity of Rhizobacteria’’. Microbiology, vol. 73, no. 2, marzo de 2004, pp. 156-158, ISSN 0026-2617, 1608-3237, DOI10.1023/B: MICI. 0000023982.76684.9d.
Lee, S.; Flores-Encarnación, M.; Contreras-Zentella, M.; García-Flores, L.; Escamilla, J. E. y Kennedy, C. 2004. ‘‘Indole-3- Acetic Acid Biosynthesis Is Deficient in Gluconacetobacter diazotrophicus Strains with Mutations in Cytochrome c Biogenesis Genes’’. Journal of Bacteriology, vol. 186, no. 16, 15 de agosto de 2004, pp. 5384-5391, ISSN 0021-9193, 1098-5530, DOI 10.1128/JB.186.16.5384- 5391.2004, PMID: 15292139.
Leveau, J. H. J. y Lindow, S. E. 2005. ‘‘Utilization of the Plant Hormone Indole-3-Acetic Acid for Growth by Pseudomonas putida Strain 1290’’. Applied and Environmental Microbiology, vol. 71, no. 5, 5 de enero de 2005, pp. 2365-2371, ISSN 0099-2240, 1098-5336, DOI 10.1128/AEM.71.5.2365- 2371.2005, PMID: 15870323.
Patten, C. L. y Glick, B. R. 2002. ‘‘Role of Pseudomonas putida Indoleacetic Acid in Development of the Host Plant Root System’’. Applied and Environmental Microbiology, vol. 68, no. 8, 8 de enero de 2002, pp. 3795-3801, ISSN 0099- 2240, 1098-5336, DOI 10.1128/ AEM.68.8.3795-3801.2002, PMID: 12147474.
Quyet-Tien P, Yu-Mi Park, Choong-Min, Seung-Hwan P, and Sa-Youl G. 2008. Functional Identification and Expression of Indole-3-Pyruvate Decarboxylase from Paenibacillus polymyxa E681. J. Microbiol. Biotechnol. (2008), 18(7), 1235–1244.
Simon, S. y Petrášek, J. 2007. ‘‘Why plants need more than one type of auxin’’. Plant Science, vol. 180, no. 3, marzo de 2011, pp. 454-460, ISSN 0168-9452.
Spaepen, S.; Vanderleyden, J. y Remans, R. 2007. ‘‘Indole-3-acetic acid in microbial and microorganism-plant signaling’’. FEMS Microbiology Reviews, vol. 31, no. 4, 2007, pp. 425–448, ISSN 1574-6976.
Vega-Celedón P., Chanchignia M. G., y Seeger M. 2016. Biosynthesis of indole-3-acetic acid and plant growth promoting by bacteria. Cultivos Tropicales, 2016, vol. 37, no. especial, pp. 33-39. ISSN impreso: 0258-5936.
Wiśniewska, J.; Xu, J.; Seifertová, D.; Brewer, P. B.; Rŭžička, K.; Blilou, I.; Rouquié, D.; Benková, E.; Scheres, B. y Friml, J. 2006. ‘‘Polar PIN localization directs auxin flow in plants’’. Science, vol. 312, no. 5775, 2006, pp. 883–883, ISSN 0036-8075, 1095-9203.
Zhao, Y. 2010. ‘‘Auxin biosynthesis and its role in plant development’’. Annual Review of Plant Biology, vol. 61, 2010, p. 49, ISSN 15452123, 15435008.
